REPORTAJE: Francisco Calderón M.

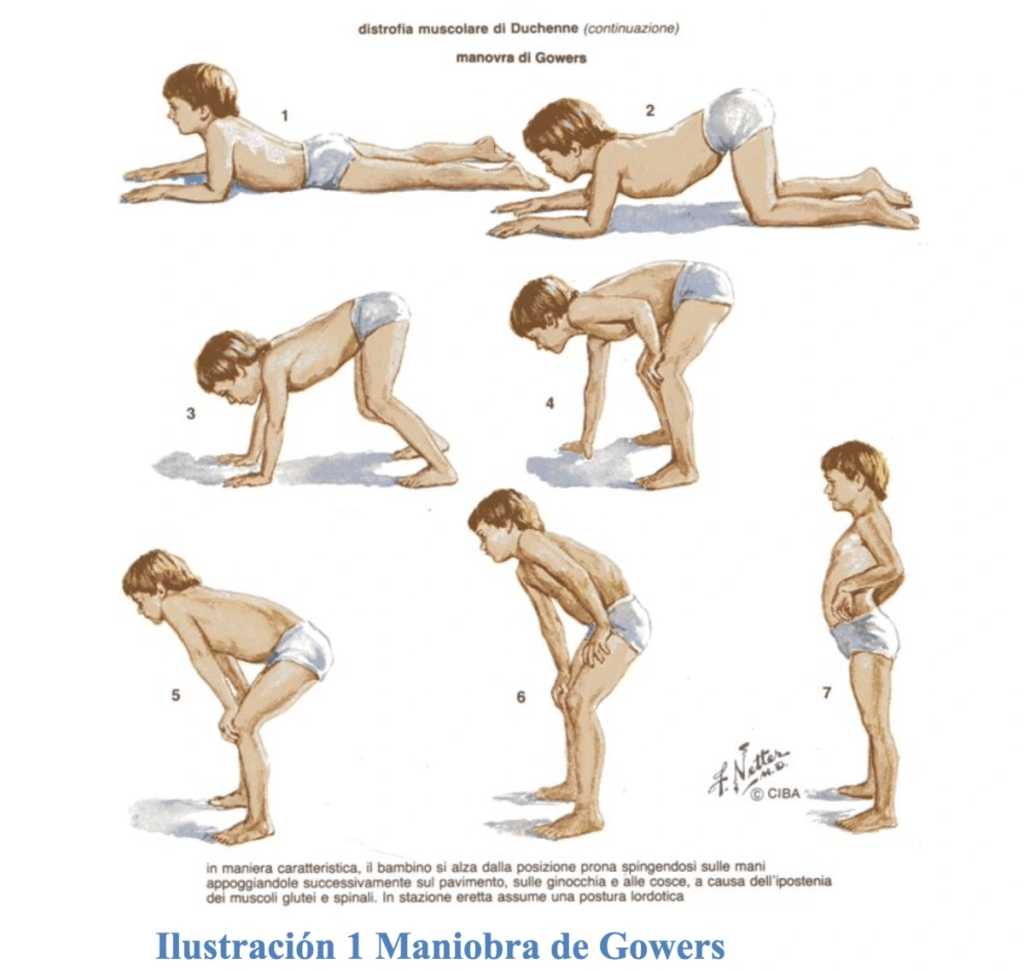
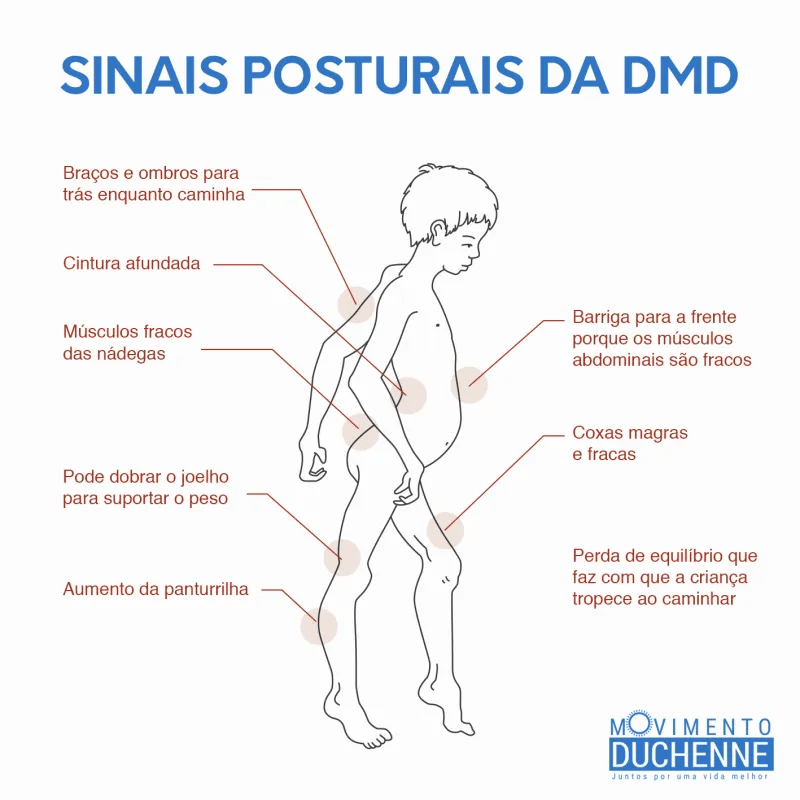
El doctor Jorge Bevilacqua, neurólogo del Hospital Clínico de la Universidad de Chile e investigador asociado de CItNe, dice que “los primeros síntomas de la distrofia muscular de Duchenne se manifiestan temprano en la infancia, afectando la adquisición de los primeros hitos motores como el gateo y la caminata. De manera progresiva, los pacientes pierden masa y fuerza muscular, requiriendo apoyo ortopédico, silla de ruedas y ventilación mecánica cuando se afecta la musculatura respiratoria, así como cardiopatía. Estas últimas son la principal causa de muerte en pacientes con distrofia muscular de Duchenne, la cual suele ocurrir en promedio entre los 20 y los 30 años de edad”.
El investigador añade que no existe cura para la distrofia muscular de Duchenne; los tratamientos que se utilizan en la actualidad son paliativos, aliviando la sintomatología de los pacientes, pero no curan la enfermedad. Entre estos se incluyen cuidados médicos de apoyo y terapia farmacológica basada en el uso de corticosteroides, los cuales permiten retrasar la progresión de la enfermedad y prolongar la esperanza de vida de los pacientes.
La doctora Arlek González afirma que “en los últimos años, la agencia norteamericana Food and Drugs Administration (FDA, por sus siglas en inglés) ha aprobado de manera acelerada el uso de lo que se llama terapias de omisión de exones, en las que se utilizan pequeños fragmentos de ADN denominados oligonucleótidos antisentido, que ayudan a las células musculares a omitir la expresión de exones específicos de distrofina afectados por las mutaciones. Esto daría como resultado la restauración de pequeñas cantidades de distrofina, lo que podría retrasar la progresión de la enfermedad, aunque sus beneficios a largo plazo aún están en evaluación”.
¿CÓMO DETECTAR EL MAL DE DUCHENNE EN LOS NIÑOS VARONES MENORES DE 2 AÑOS?
En esta misma línea, continúa la investigadora, el año recién pasado, la FDA aprobó la terapia génica denominada Elevidys, un virus adenoasociado del serotipo 9 (AAV9), el cual administra de manera exógena un gen que codifica para una microdistrofina recombinante. Esta proteína sería de menor tamaño que la distrofina endógena pero funcionaría de manera similar, “restaurando” las funciones perdidas en el contexto de la distrofia muscular de Duchenne.

“Elevidys es una terapia de administración única (intravenosa) con un elevadísimo costo de producción que se traduce en un costo inalcanzable para los pacientes, bordeando los tres mil 200 dólares, unos tres mil 500 millones de pesos chilenos. La generación de este tipo de terapias génicas, cuyos alcances aún están en etapa de investigación, requiere de procesos productivos en laboratorios de alta complejidad, con elevados niveles de bioseguridad que garanticen su inocuidad para el ser humano, lo que eleva enormemente sus costos”, explica la doctora González.
TERAPIA EN EVALUACIÓN.
El doctor Jorge Bevilacqua sostiene que “se debe tener en consideración que existe una ventana temporal de administración en la que esta terapia génica generaría mayores beneficios para los pacientes, la cual se da entre los cuatro y cinco años de edad, por lo que el pequeño Tomás cumple con los criterios requeridos para recibir el tratamiento. No obstante, se debe tener claridad en que no existe ninguna garantía de que Elevidys eliminará completamente los síntomas de la distrofia de Duchenne, pues esta es aún una terapia que está en evaluación. De administrarse, es necesario el monitoreo exhaustivo de los pacientes para analizar los potenciales efectos secundarios”.

¿Y EL ZOLGENSMA QUÉ ES Y CUÁNTO VALE?
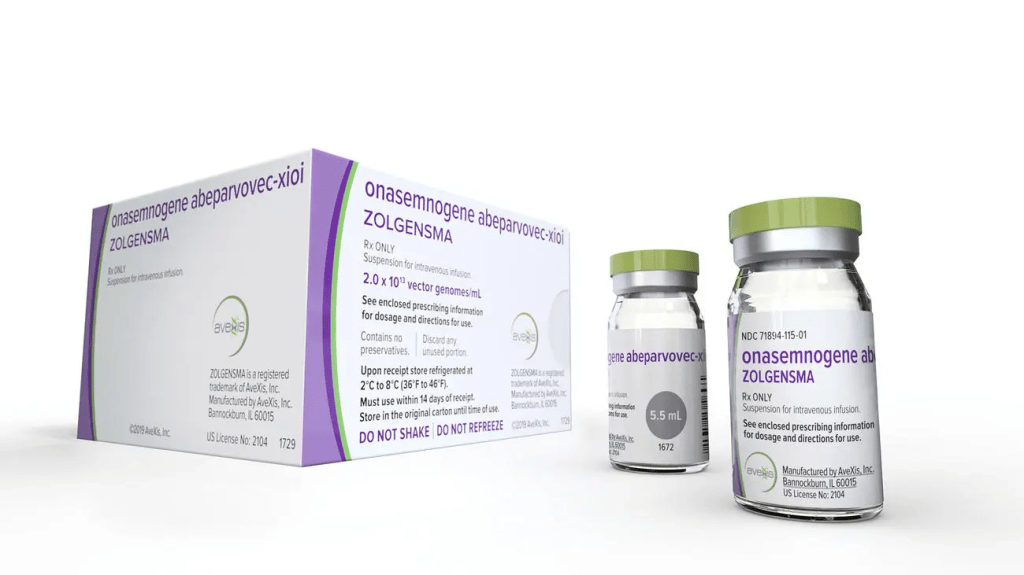
Zolgensma, el fármaco aprobado recientemente es una terapia génica: un campo relativamente nuevo pero en rápido crecimiento en el desarrollo de medicamentos en el que una copia correcta de un gen reemplaza al material genético mutado que causa la enfermedad. En cierto sentido estas terapias abordan la causa raíz de una enfermedad (un gen defectuoso) y al hacerlo podrían eliminar gran cantidad de enfermedades infantiles mortales, trastornos sanguíneos poco frecuentes y cánceres hereditarios.
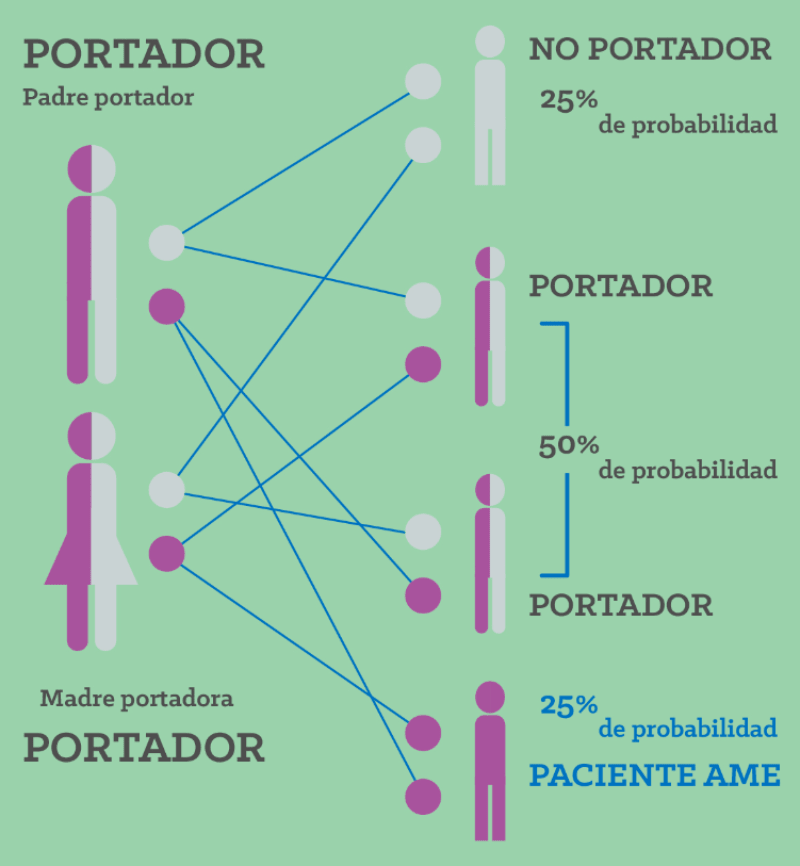
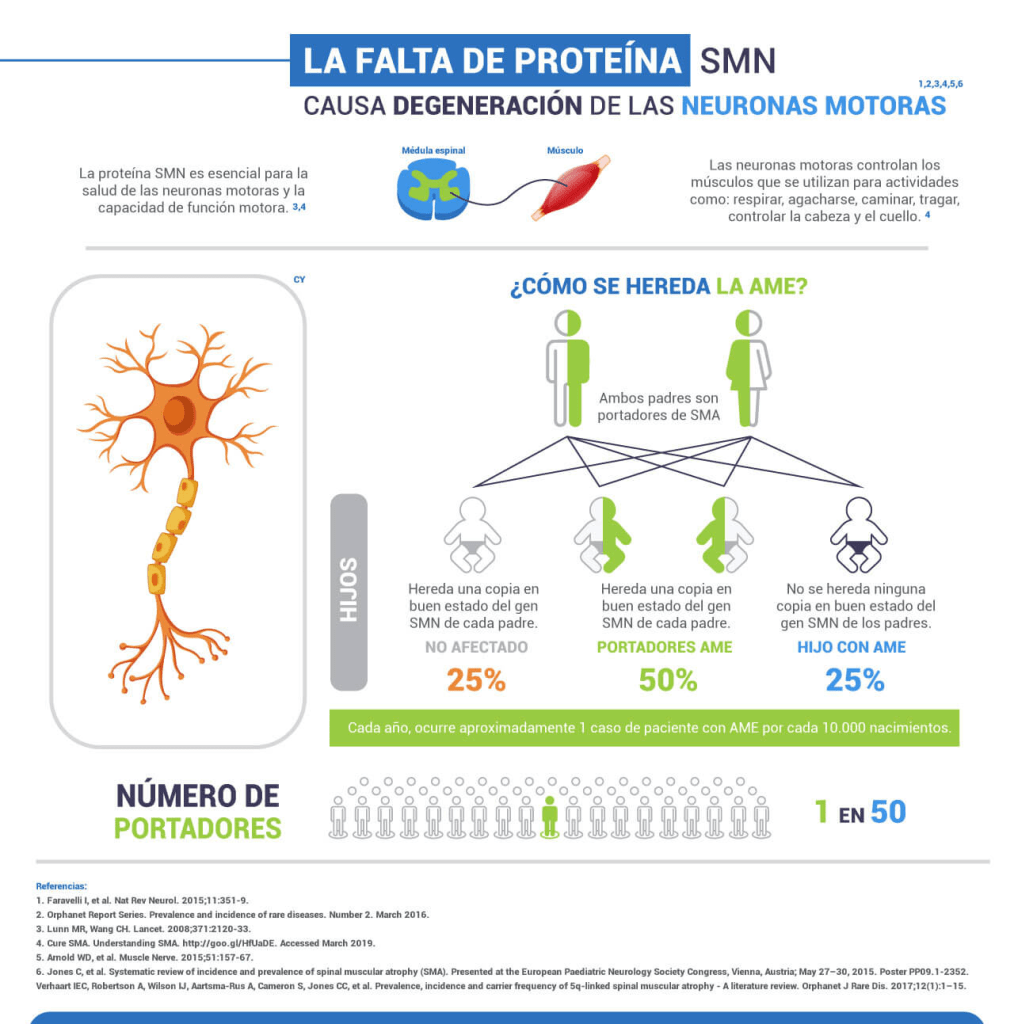
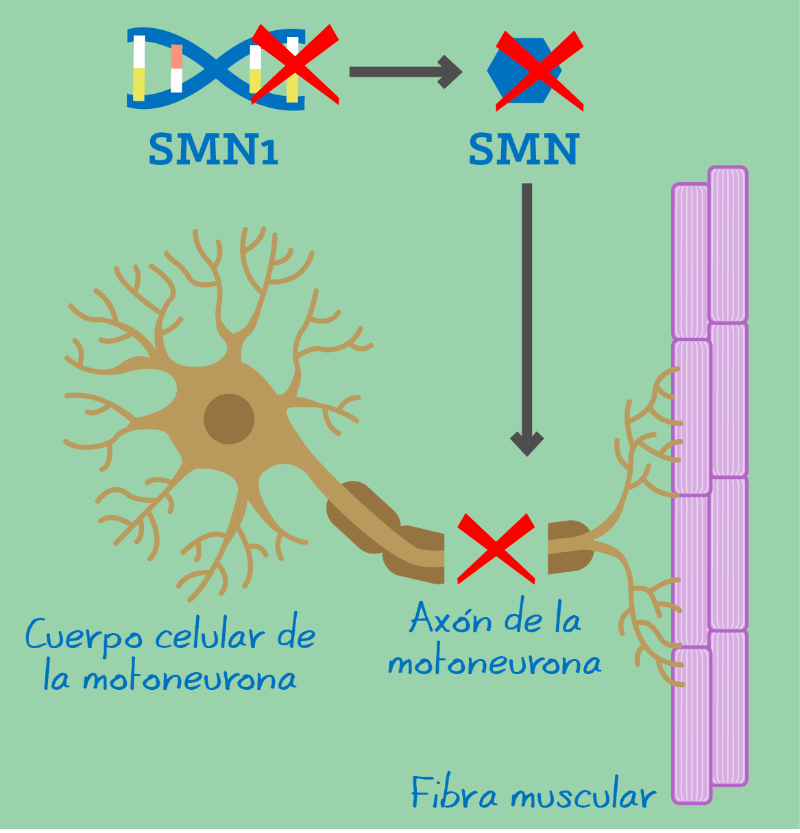
Zolgensma trata la atrofia muscular espinal enfermedad mortal causada por un defecto genético que debilita los músculos de una persona de manera tan drástica que se vuelven incapaces de moverse y, eventualmente, puede dañar la capacidad de tragar o respirar. Los bebés que nacen con la forma aguda de la enfermedad a menudo mueren antes de los dos años de edad. Uno de cada 10 000 recién nacidos aproximadamente está afectado por la enfermedad, lo que la convierte en una de las enfermedades raras más comunes.
Zolgensma es el 17º tratamiento celular y genético en la lista aprobada por el organismo regulador de Alimentos y Fármacos de Estados Unidos (FDA, por sus siglas en inglés). Pero de aquí al año 2025, este organismo espera aprobar cada año de diez a veinte terapias celulares y genéticas. Unos 2 600 ensayos clínicos de terapia génica están en marcha o se han completado en 38 países.
Con adquisiciones recientes de algunas empresas biotecnológicas más pequeñas, las farmacéuticas suizas Novartis y Roche están a la vanguardia de la revolución de la terapia génica.
Zolgensma no es el único tratamiento que sorprende por su precio. Hace unos años, en Suiza se suscitó el debate en torno a los más de 60 000 dólares que costaba un medicamento para tratar la hepatitis C.
En la CNBC, el director general de Novartis, Vas Narasimhan, argumentó que: «las terapias génicas representan un avance médico en el modo en que ofrecen la esperanza de curar las enfermedades genéticas mortales con una sola dosis. En algunos casos, la alternativa es un tratamiento de múltiples dosis con mejoras progresivas».
Zolgensma, aprobado para niños menores de dos años, es una única infusión intravenosa que dura aproximadamente una hora. Roche también está desarrollando una solución oral para la enfermedad.
La alternativa es el tratamiento actual comercializado bajo la marca SpinrazaEnlace externo, que se toma cuatro veces al año de por vida. El precio es de 750 000 dólares el primer año. Durante los años sucesivos cuesta 350 000 dólares al año, es decir, alrededor de 4 millones de dólares por década.
El grupo independiente sin ánimo de lucro Institute for Clinical and Economic Review (Instituto de Revisión Clínica y Económica) que evalúa el valor de los nuevos y costosos fármacosEnlace externo, ha calculado que, a un coste de entre 1,2 y 2,1 millones de dólares, el precio de esta nueva terapia génica es justificable porque “transforma por completo la vida de las familias afectadas por esta devastadora enfermedad”.
En gran parte está basado en los costes por año de vida ganado al comparar los resultados de los ensayos clínicos para las opciones de tratamiento.
Contenido externo
Hay varias. La primera es cómo se fija el precio y qué márgenes tienen las farmacéuticas; sobre todo si se tiene en cuenta lo poco que se sabe sobre los costes de desarrollar estos medicamentos. Novartis no ha desarrollado Zolgensma, sino que se ha hecho con ella a través de la compra por 8 700 millones de dólaresEnlace externo de la empresa estadounidense AveXis.
Además, muchas compañías argumentan que los precios se calculan utilizando un modelo basado en el valor, y esto plantea una serie de preguntas complicadas sobre cuánto vale una vida. También hay pocas pruebas sobre si los tratamientos son efectivos y presentan posibles riesgos, especialmente a largo plazo. Algunas terapias que han salido al mercado, como Imlygic, no han estado a la altura de su potencial.
Esto se complica por el hecho de que muchas terapias génicas abordan las enfermedades raras, en el sentido de que tienen el potencial de mejorar de manera contundente la vida de unas pocas personas. Existen algunas críticasEnlace externo que dicen que esto está alejando la atención de enfermedades más comunes como la diabetes y la hipertensión.
También existen relacionadas con la manipulación genética y miedo a un peligroso camino que lleve a los bebes.
En última instancia, la principal fuente de debate es cómo va a pagar la sociedad estos tratamientos tan costosos. La mayoría de los sistemas de seguros sanitarios no están diseñados para asumir tratamientos de una sola vez a ese precio. Novartis ya ha dicho que está trabajando con las aseguradoras para permitir pagos a lo largo de cinco años, a razón de 425 000 dólares anuales, y hará reembolsos parciales si el tratamiento no funciona. Pero no está claro cómo funcionará esto en cada país.
FUENTE: Swissinfo.ch – KmedHealth.com y UV.CL, Universidad de Valparaíso

